卵巢癌细胞外囊泡可促进凝血过程并具潜在的诊断价值

卵巢上皮癌(EOC)是妇科恶性肿瘤中最常见的肿瘤,70%的患者在晚期被确诊。虽然手术与铂类、紫杉碱类化疗结合的方法可显著提高EOC患者的总生存率,但其5年生存率仍仅为45%左右。缺乏早期有效的诊断筛查方法是死亡率高的主要原因之一。肿瘤标志物CA125的检查和超声检查是临床上公认的卵巢癌诊断的主流检测手段。然而,由于CA125的非特异性,故而无法有效地区分恶性肿瘤与良性肿瘤。
细胞外囊泡(EVs)是一种小的(40-1000nm)由膜包裹的微囊泡结构,在细胞间通讯中起着重要的作用。涉及多方面的生理和病理活动,包括凝血、血管生成、细胞存活、调节免疫反应、以及炎症相关。处于循环中的EVs来自多个细胞,如血小板、炎症细胞、单核/巨噬细胞和卵巢癌细胞。由于循环EVs携带来自供体细胞的复杂生物信息,并且可以通过非侵入性途径获得,因此正逐渐成为一种新型的癌症生物标志物。本研究利用相对和绝对定量同位素标记(isobaric tags for relative and absolute quantification, iTRAQ)串联液相色谱-质谱技术(LC-MS),对卵巢癌患者和健康女性的EVs蛋白进行了系统研究,旨在识别差异表达的蛋白,并研究其生物学功能和诊断生物标志物的潜力。
材料方法
本研究通过定量蛋白质组学分析技术(iTRAQ)对10例晚期(III-IV期)EOC患者和10例对照组进行分析。20例EOC患者和20例对照组进行ELISA了验证。而候选标志物蛋白在另外40对队列中进行进一步的验证,以研究其生物标志物潜力。该研究通过电子显微镜成像技术(EM),蛋白免疫印迹技术(WB)及纳米微粒追踪分析术(NTA)对分离到的外泌体进行鉴定。通过测定凝血因子X的活性来确定凝血级联反应的激活。
结果
1. 循环EVs的分离与鉴定
分离的循环EVs经EM、western blotting和NTA鉴定。其具有典型的大小、形状和蛋白标记物,这表明从EOC患者和对照组中成功分离出高质量的循环EVs。

2.10对样本的蛋白质组学及生物信息学分析
与对照组相比,EOC组有200个蛋白上调,208个蛋白下调。最重要的参与途径是补体和凝血级联通路。
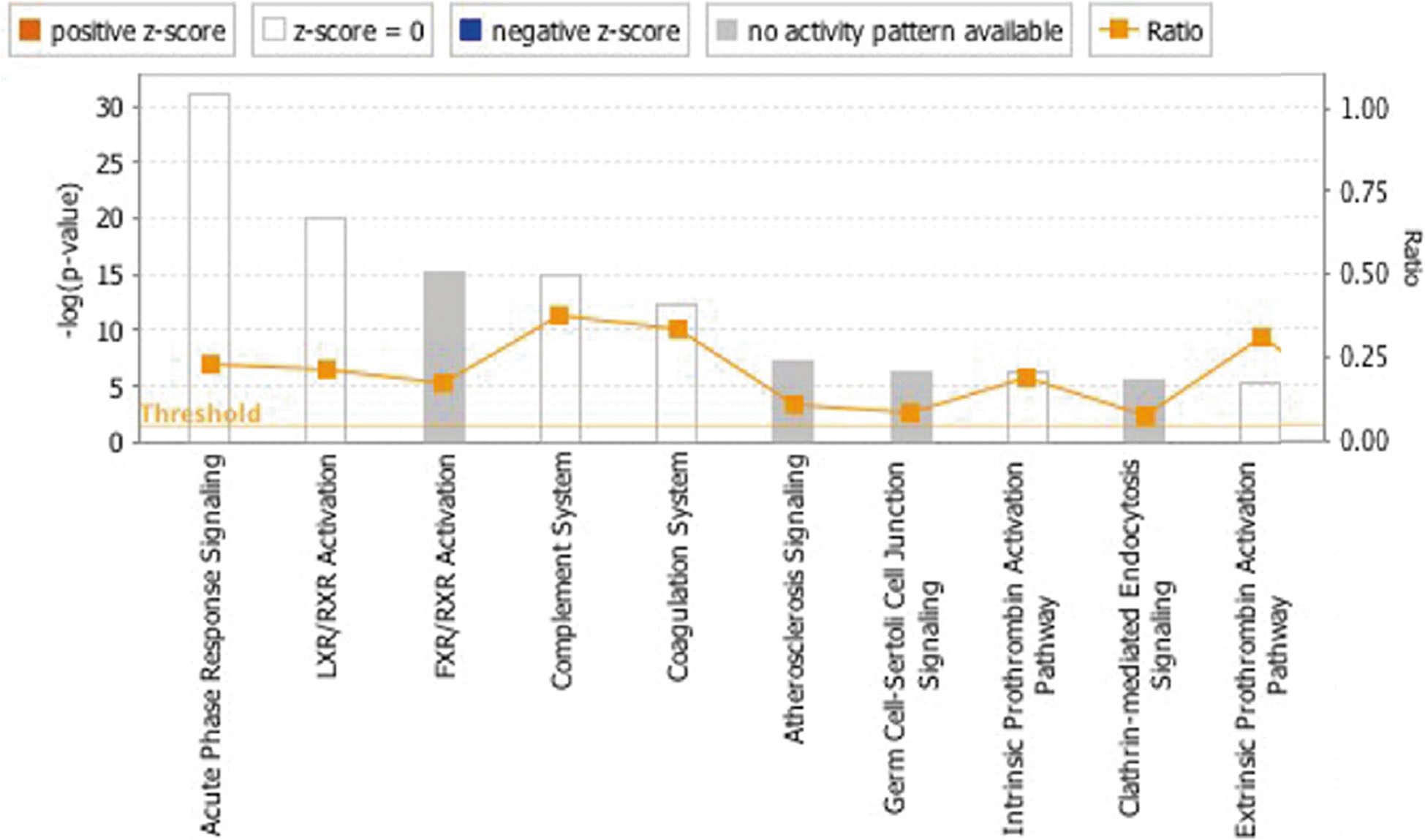
3.20对样本的ELISA验证及5个候选标志物的潜能验证。
对通过蛋白质组学找到的差异蛋白质结果进行ELISA验证,并确定5个候选标志物。

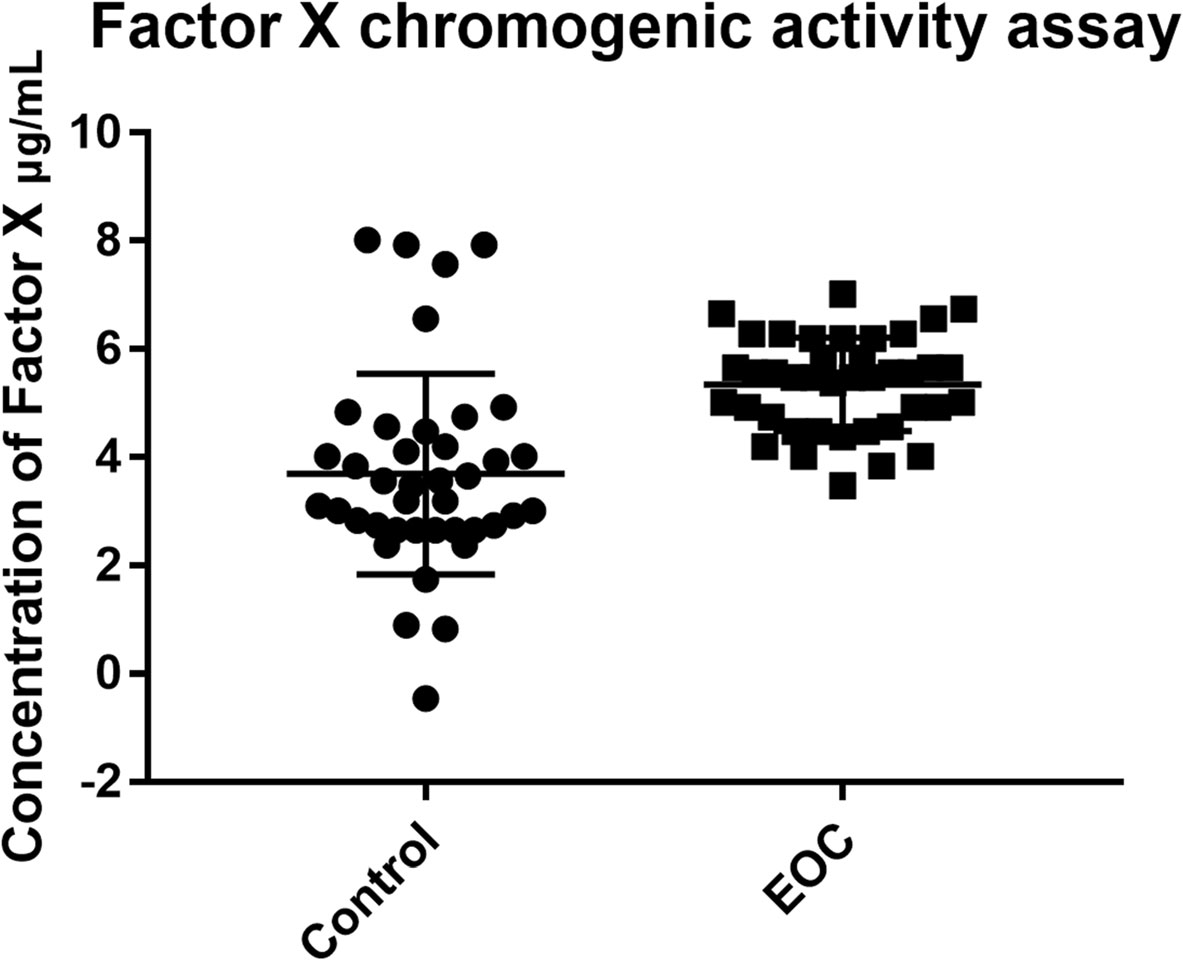
4.40对样本的凝血因子X活性测定及候选标志物的统计学分析
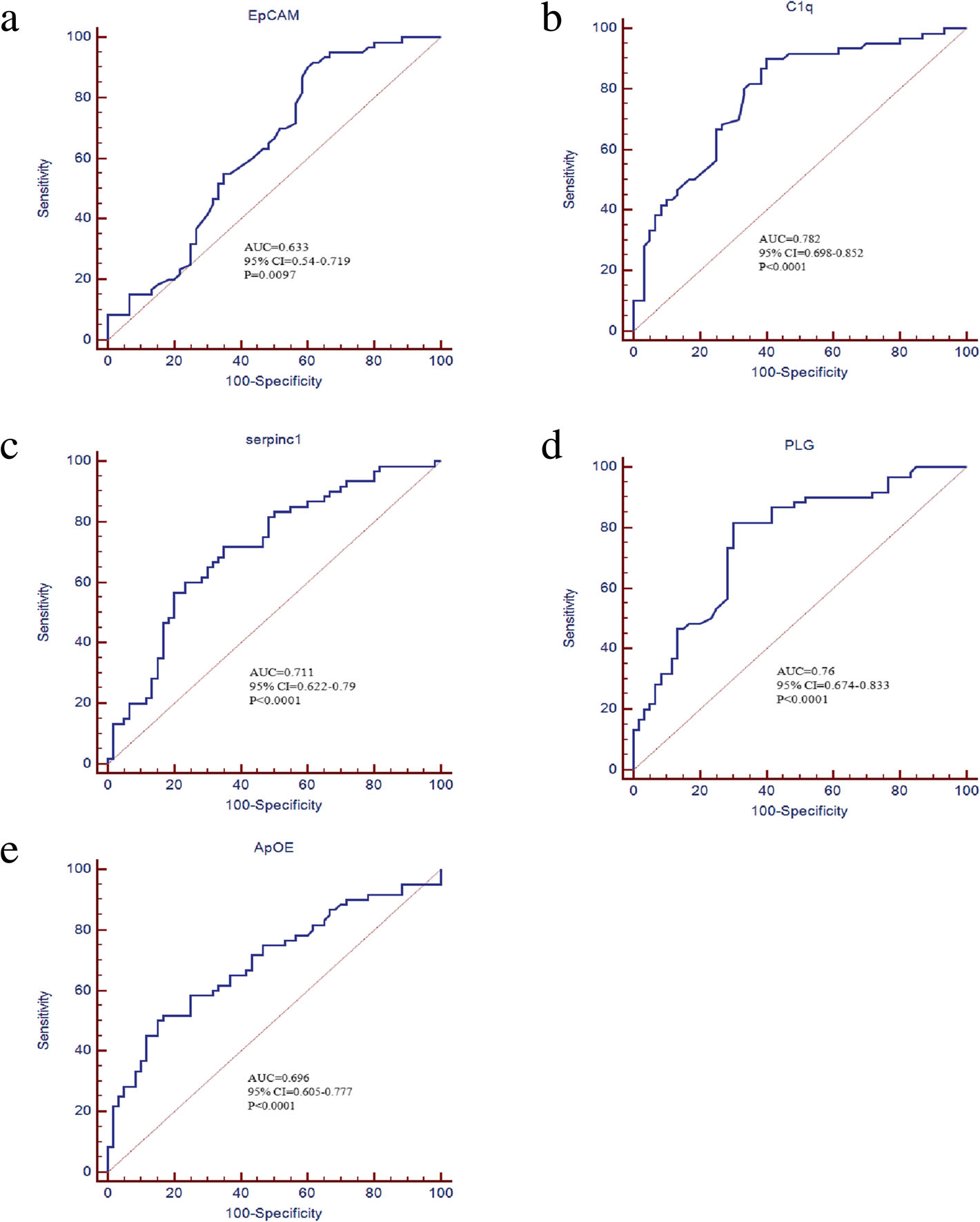
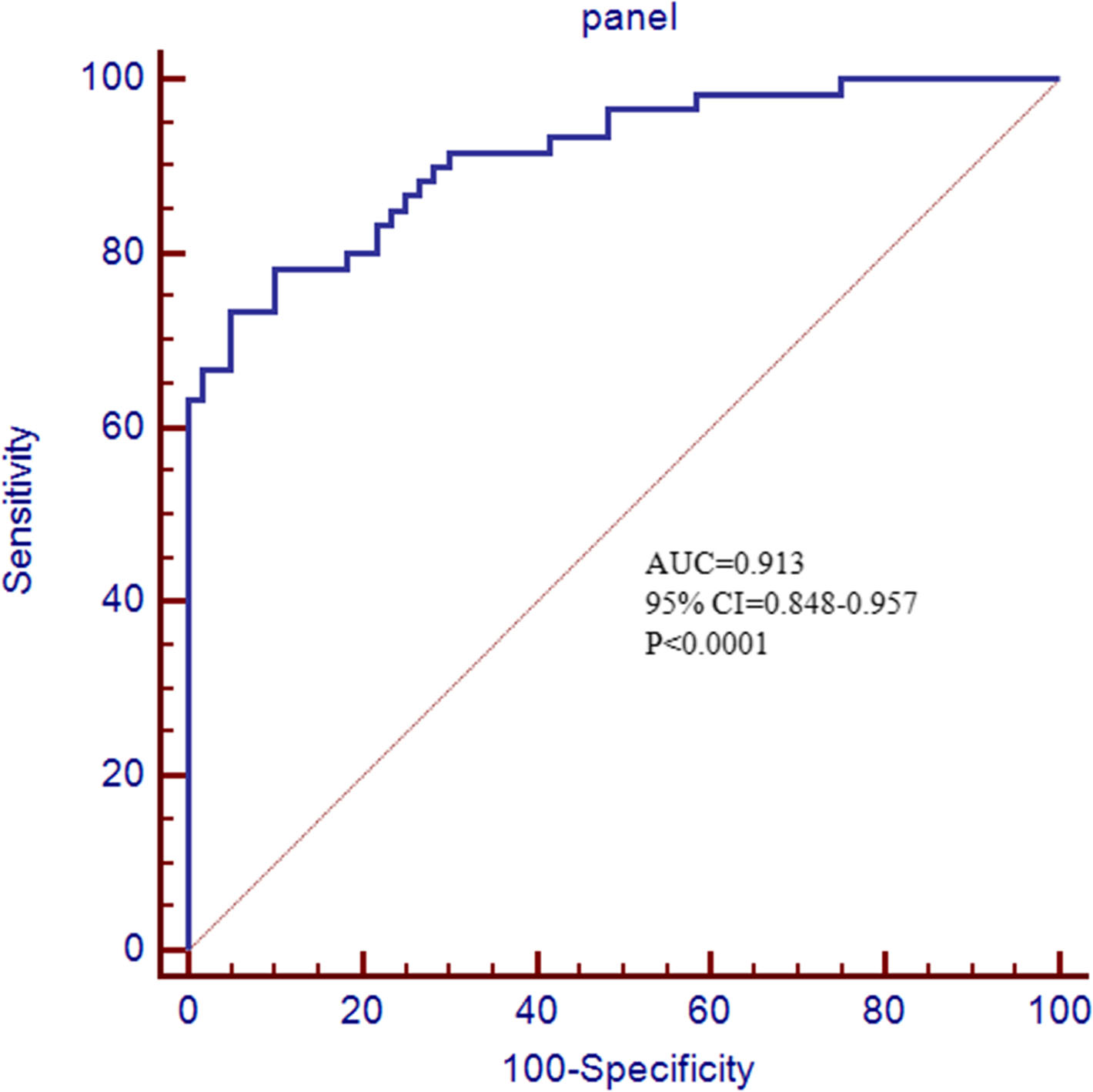
EOC组中凝血因子X对Xa因子的激活程度高于对照组(5.35±0.14 vs. 3.69±0.29,p < 0.0001)。5个候选标志物的单独ROC曲线及多变量的logistic回归分析表明,5个候选标志物的联合为EOC的诊断提供了最佳的诊断信息,AUC = 0.913(95%置信区间(CI) = 0.848-0.957, p < 0.0001)。
结 论
该研究支持循环的EVs作为非侵袭性诊断卵巢癌的工具。EVs在凝血过程中也起着关键作用,提示了卵巢癌患者在晚期常发生的血栓形成的内在机制。
研究亮点
利用iTRAQ标记耦合LC-MS技术对卵巢癌和健康状态下的循环EVs蛋白进行了系统研究,证实了循环EVs作为癌症患者体液活检生物标志物的概念。并揭示了EVs蛋白在卵巢癌中的综合表达,为进一步的评价提供了多方面的依据。
参考文献:
