蛋白质组学分析间充质干细胞外泌体揭示通过NFkB信号通路调节血管生成
外周动脉疾病(PAD)是一种缺血性组织相关疾病,目前没有有效的治疗方案。该疾病特点是由于动脉粥样硬化斑块引起的动脉血管狭窄或堵塞而导致血流供给不足,血管成形术和支架置入术是主要的治疗手段。然而,术后再狭窄和再阻塞以及支架的过度生长均会限制治疗效果。PAD动物模型相关研究表明,通过重组血管内皮生长因子诱导局部血管生成的方法可直接有效治疗PAD。
骨髓来源的间充质干细胞(MSCs)通过向免疫细胞和内皮细胞等内源性细胞群传递信号来促进组织愈合。因为其分泌大量的血管生成信号蛋白,所以,MSCs也被认为是一种潜在的治疗外周动脉疾病的方法。
外泌体是一种细胞分泌的30-150 nm的囊泡,通过在细胞间运输蛋白质和RNA来介导细胞间通讯。研究表明,MSCs外泌体作为血管生成的效应因子帮助血管再生。然而,外泌体的作用及识别机制仍然未知。为了解决这个问题,本研究使用了高分辨率等电聚焦液相串联质谱法(HiRIEF LC-MS/MS),这是一种非靶向的高通量蛋白质组学方法来全面测绘MSCs和MSCs外泌体的蛋白质谱图。
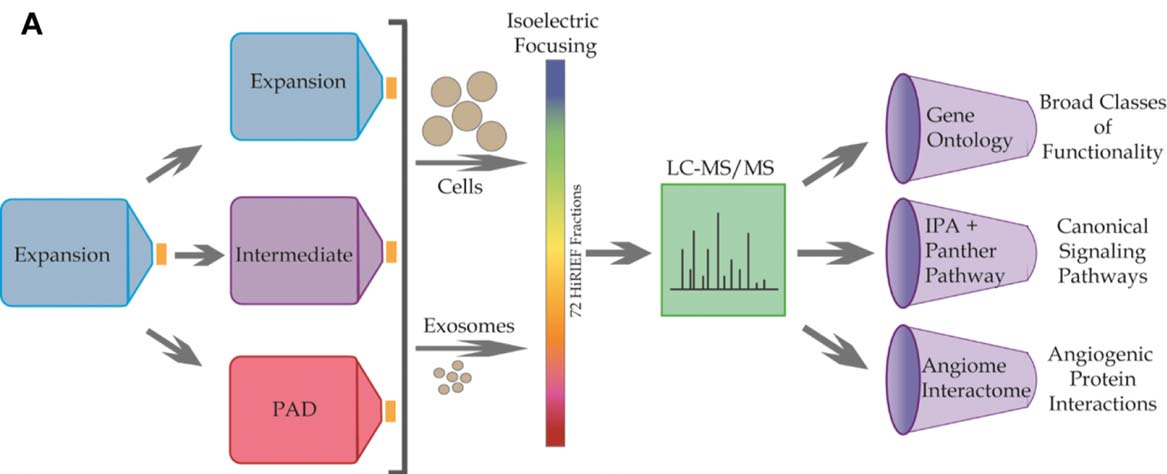
方法与结果
MSCs促进血管生成的能力随其所处微环境的变化而变化。在注射到动物模型之前,骨髓间充质干细胞通常在高血清(10%-20%)且含氧(常氧,21% O2)的培养基中培养。然而,当MSCs被注射到PAD影响的组织中时,由于血流量的缺乏,MSCs会处于明显降低的氧气浓度和血清浓度环境中。因此,该研究设定了正常组(Expansion, EX),中间过度组(Intermediate, IC)和PAD组。
注:EX:20% FBS, 21% O2, PAD: 0% FBS, 1% O2,IC: 0% FBS, 21% O2
1.将MSCs在三种不同条件下进行培养,测定其蛋白质组水平差异。
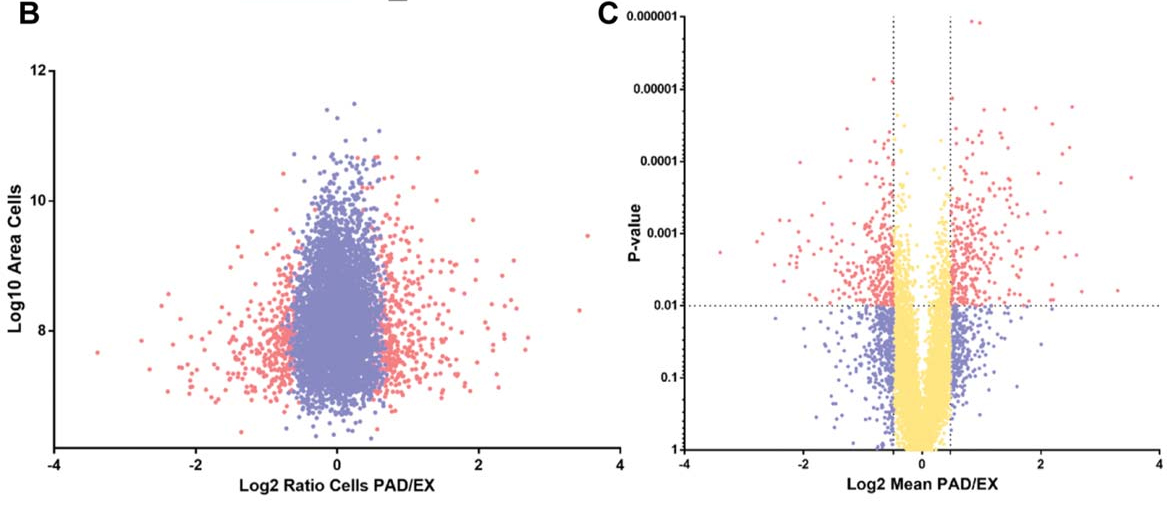
利用蛋白质组学技术共鉴定到6342个蛋白,其中580个蛋白质与膜相关。与EX相比,在IC和PAD条件下分别鉴定到315和843个差异蛋白。
2.针对MSCs差异蛋白的生物信息学分析
通过Heatmap,ClueGO 及Panther分析发现,在PAD条件下,与糖酵解,谷胱甘肽通路相关蛋白丰度显著上调,而在IC条件下无显著变化。与细胞周期及细胞增值相关的蛋白质丰度显著降低,而与胆固醇和脂质生物合成途径相关蛋白质丰度均上调。
通过蛋白质互作网络分析,发现相互作用最活跃的几个节点分别是血小板衍生生长因子受体(PDGFR)、表皮生长因子受体(EGFR)和NFkB。这些数据表明,与血管生成信号通路相关蛋白丰度上调。
3.在模拟PAD条件下,MSCs外泌体分泌受到促进。
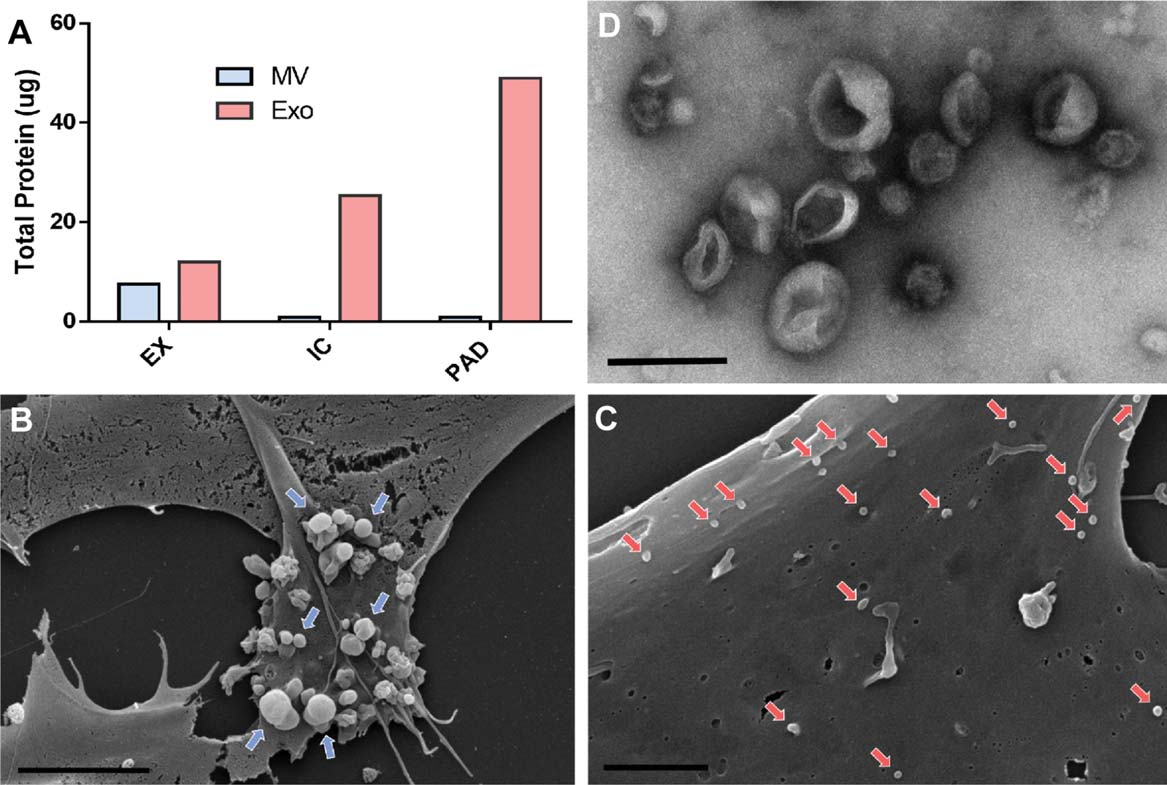
与对照相比,在IC和PAD条件下,细胞增殖速度降低,因此对新合成质膜成分的需求也会降低,但我们发现胆固醇/脂质生物合成蛋白(FDR1%)的表达丰度却显著增加,并没有降低。因此我们推测,MSCs分泌外泌体过程受到促进。
通过超速离心法提取外泌体,通过扫描电子显微镜观察到与EX相比,IC和PAD条件下外泌体分泌量增加,且提取的外泌体大小也符合预期。
4. MSCs外泌体蛋白质组学分析及生物信息学分析
该研究利用HiRIEF LC-MS/MS对在IC和PAD条件下的MSCs外泌体蛋白质组进行了分析。共有1927个蛋白被鉴定到,其中457个蛋白未在MSCs中检测到,只在外泌体中被富集。通过GO、ClueGO及Panther等进行分析,发现了几个与血管生成通路相关蛋白高表达,即钙粘蛋白、EGFR、FGF和PDGF。IPA分析显示MSCs外泌体内含有大量具有多种与血管生成相关的功能的的蛋白质。对MSCs外泌体的血管生成相互作用网络分析发现,最活跃的几个节点是典型的参与血管生成通路的的蛋白,如:NFkB1/2,PDGFRB,和EGFR。与MSCs蛋白质组学分析结果相类似。
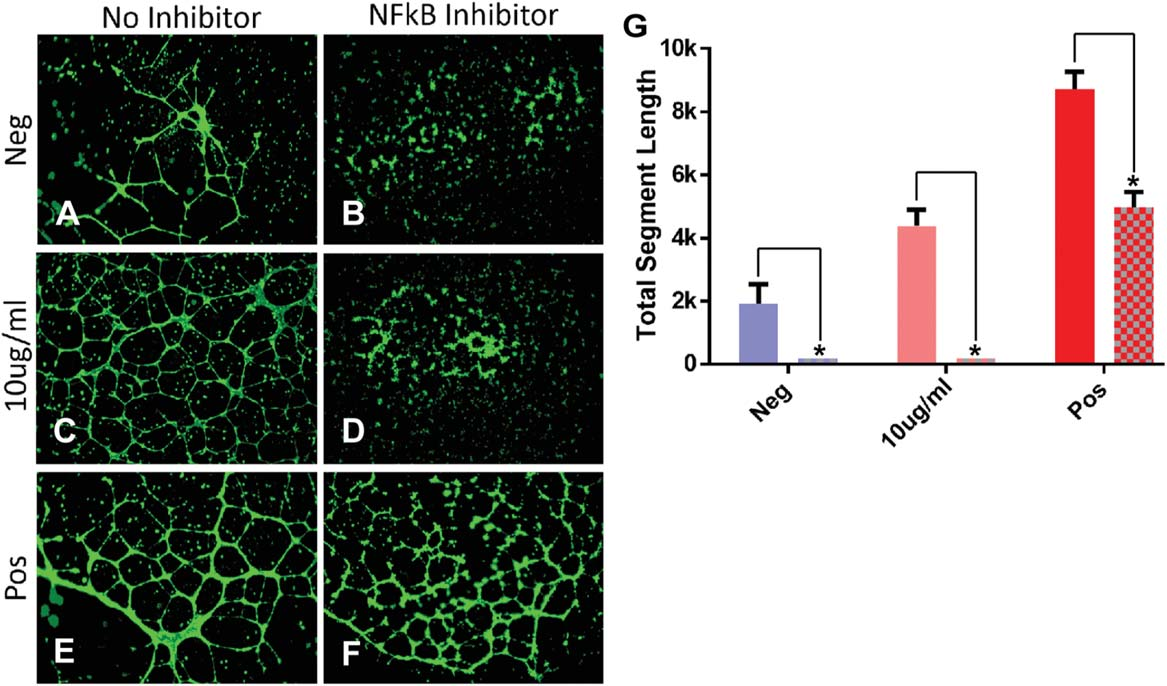
5.MSCs外泌体诱导血管生成的能力评估。
利用在PAD条件下培养的MSCs处理内皮细胞,测定其体外促进血管再生的能力。通过血管形成的总长度来衡量其再生能力,并确定其具有一定的剂量范围。
已知(pyrrolidine dithiocarbamate, PDTC)是一种已知的NFkB抑制剂,发现PDTC处理后的内皮细胞,即使在PAD条件下培养的MSCs细胞的刺激下也不能促进血管的生成。这些结果表明,MSCs调节血管的生成过程依赖于NFkB。
结论
该研究证明MSCs外泌体诱导的血管生成过程依赖于NFkB信号通路。
研究亮点
分别分析在EX,IC,PAD条件下,利用蛋白质组学技术研究MSCs细胞及其外泌体的蛋白质情况,发现其具有促进血管的再生的能力,且该能力依赖于NFkB信号通路。
参考文献:
Comprehensive Proteomic Analysis of Mesenchymal Stem Cell Exosomes Reveals Modulation of Angiogenesis via Nuclear Factor-KappaB Signaling PMID: 26782178 PMCID: PMC5785927 DOI: 10.1002/stem.2298
